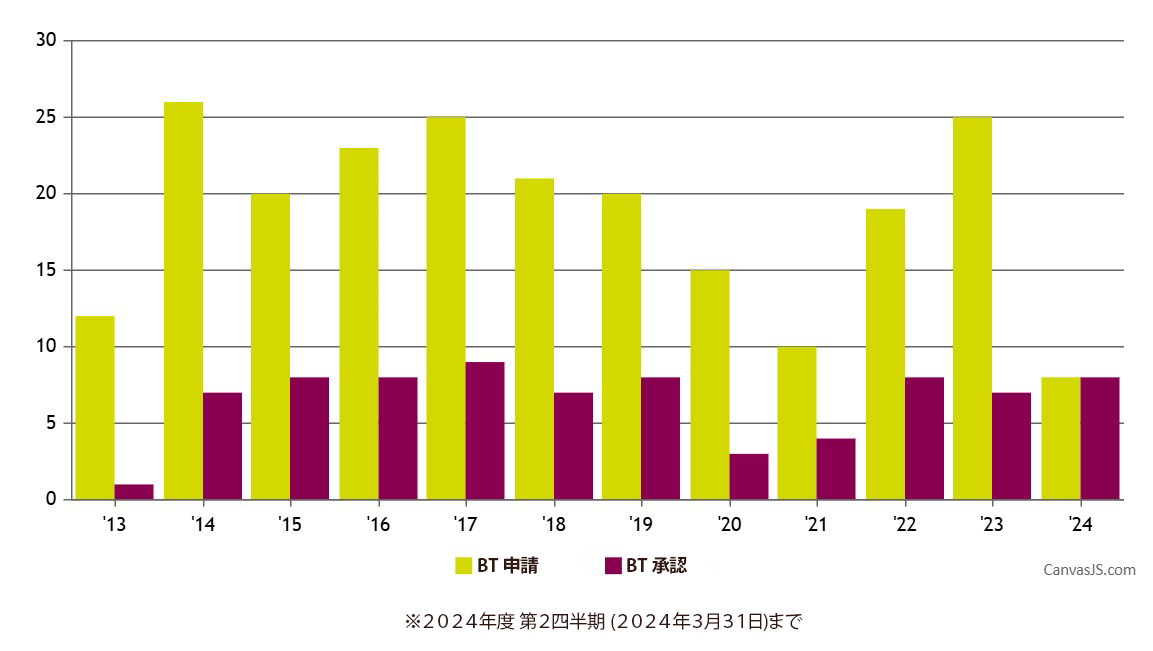
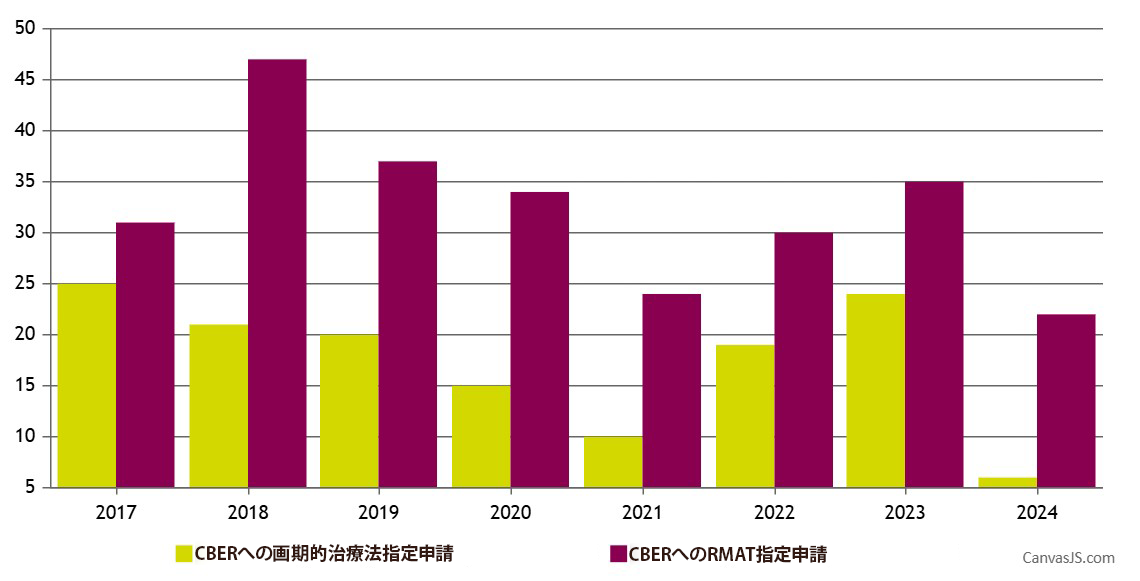
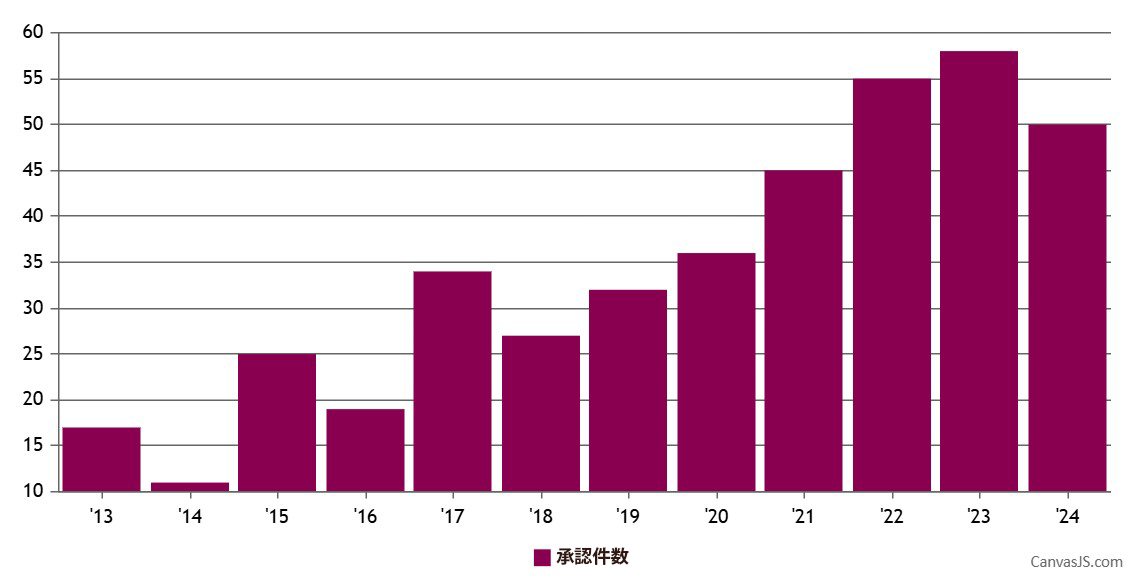
CBERパイプラインで急成長しているCGT品目にとって、RMATが同じ規制上のベネフィットを利用する選択肢となるということを考慮すると、BTD承認件数が抑えられていることは驚くべきことではありません。
正式に提出する前に、BTD申請の見込みについて非公式のフィードバックを治験依頼者が依頼できる経路が確立されていることが重要です。RMAT指定を受けるに至った特定の治験依頼者が、その時点での臨床データの性質と量に基づいて、この非公式な助言プロセスによってBTD申請の提出を控えるよう助言を受けたかどうかは不明です。また、RMAT提出の見込みに対して、非公式のフィードバックを提供する同等のプログラムは存在しないということも付け加えておかなければなりません。
Steve Winitsky, M.D.
Vice President - Technical
実際、担当機関の非公式のブレイクスルー治療助言プロセスの成果がほとんど知られていないということは、BTD申請をすぐに提出できる用意が整っている企業の割合が少ないことを示しています。2015年5月から2018年4月までに医薬品評価研究センターが開催したBT助言の事前会議に関する2019年のFDAの調査によると、245回の開催のうち、各時点でBT申請の提出が「妥当である」と同センターが助言するに至った会議は20%にとどまりました。ほぼ半数 (44 %) の会議で、各時点で「正式なBTD申請の提出は時期尚早である」との助言を治験依頼者が受けています。