より良い医薬品のために
早期段階の意思決定は、有望なイノベーションの長期的な成功にとって極めて重要です。パレクセルの多角的な早期段階のアプローチは、臨床的根拠を強化し、PoC (概念実証) への道のりを加速します。また早期段階と後期段階の開発間の空白を縮小することで、患者さんに早期に高インパクトな治療法を提供できるよう支援しています。
早期の臨床開発は迅速に進められ、重要な意思決定を支援し、将来の成功の基盤を築くための適切なデータを迅速に提供する必要があります。パレクセルは多様な専門分野を効果的に統合し、複雑な課題を解決します。また研究設計と実施を最適化することで、意思決定を加速し、アセットの最適な進路を決定するための支援を提供しています。
- 規制に関する専門知識 – グローバルな規制戦略に関する専門的な助言と、臨床開発プログラムを開始する前に規制当局との早期連携を行います。 包括的な助言には、ファストトラック/ブレークスルー療法指定の最適な機会に関するアドバイスも含まれます。
- トランスレーショナル メディシン – ゲノム専門知識と最先端のメソドロジーを応用し、患者さんの独自のゲノム特性とバイオマーカー特性に基づいて治療を提供する新規療法の開発を支援します。
- 臨床薬理学 センターオブエクセレンス – 臨床試験のデザイン、データ解析、試験結果の解釈、主要な規制地域での多様な適応症の医薬品の開発・承認戦略に関する科学的、実務的、規制における専門知識を提供。
- モデルに基づく医薬品開発 – 臨床試験デザイン、用量選択、ターゲット集団の特定を導く定量的な科学ソリューション。
- グローバルなサイトネットワークに早期臨床試験ユニットを統合 – 健康ボランティア、ニッチな患者集団、ヒト初投与からPoC (概念実証)までの患者さんを対象とした研究において、包括的な能力と柔軟なソリューションを提供。
- ポートフォリのオデューデリジェンスと臨床開発戦略 – 実行可能な開発・商業化戦略を基盤に、新興科学を有望なアセットへ迅速に転換。臨床開発計画とプログラムの監督により、早期段階から規制当局への申請まで、効率的かつ連携した開発を保証。
他分野連携のアプローチは、早期段階の複雑さを効果的に管理することでリスクを軽減し、迅速に後期段階の開発へ移行する最もコスト効率の良い方法です。
-Oli Fuhrmann, Executive Vice President, Head of Early Phase Development and Regional Head, Clinical Research Innovations, Europe
開発の生産性を向上させるための早期のインサイト
- バイオファーマ戦略と臨床開発サービスでリーダーシップを発揮する弊社では、アセット優先順位付け戦略からターゲット製品プロファイル (TPP)の開発まで、早期の科学的コンサルティングから臨床開発計画までを網羅し、規制当局の承認と商業的成功への道筋を明確に策定します。
- トランスレーショナル メディシンは、有用なバイオマーカーの探索から疾患システムのバイオシミュレーション、臨床試験におけるDNAプロファイリングの活用まで、幅広い分野の進歩を包含しています。パレクセルでは次世代の解析ツールと技術を活用し、クライアントが診断、予後、予測に役立つバイオマーカーを特定することで、その後の開発段階で検証可能な形に導く支援を提供しています。
レギュラトリー戦略の差別化
- 弊社の専門知識によって規制当局との早期協議を最大限に活用し、開発遅延のリスクを最小限に抑えます。これらの相談は、新薬申請前や販売承認申請前の会議と同様に、成功にとって極めて重要です。パレクセルの規制コンサルティングチームは、クライアントがこれらの影響力の大きい早期助言会議に備えるお手伝いをしています。パレクセルの数十年にわたるレギュラトリーに関する専門知識は、スポンサーがファストトラック/ブレークスルー療法の指定を最も効果的に活用する方法について指導する際、特に効果的です。
弊社のレギュラトリー専門家チームは、年間100件以上のIND/IMPD申請と80件以上の当局との会議に対応しています。 - 臨床、非臨床、CMCの幅広い経験を有するレギュラトリーの専門家が、類似の開発プログラムにおける豊富な経験に基づき、利用可能なデータをレビュー・評価します。これにより、規制当局向けのデータパッケージにおける潜在的なギャップを特定することで、各ギャップを埋めるための対策を提案し、開発の円滑な進展を確保します。
スマートで迅速な治験を実現する能力と革新性
- 先進的な手法 - 弊社は利用可能なすべての非臨床薬物動態(PK)および薬力学(PD)データを活用し、ヒトにおけるPK/PDを予測するようお客様に提案しています。定量的アプローチを用いることで、モデリング シミュレーションチームが有望な候補薬の開発を最適化し、開発初期段階で有望性の低い候補薬を見極めるサポートを行います。場合によってはモデリングとシミュレーションにより、治験デザインを支援したり、初期の臨床試験自体を代替したりすることも可能です。
- グローバルな初期フェーズでのパートナーエコシステム -- ヒト初回投与試験から患者対象試験まで、経験豊富なスタッフによる厳格な監督と標準化された手順に支えられた最先端のグローバル施設が、患者さんの安全を確保しつつ統合的なデータを提供する最適な環境を実現しています。弊社の初期フェーズ施設ネットワークは、5大陸にわたり50ヵ所以上に及びます。
- 適応デザインと統合プロトコルに関する深い専門性。これらは複数の初期フェーズ試験を単一プロトコルに統合し、治験の継続/中止判断を迅速化します。パレクセルの経験はデザインに留まらず、規制要件を満たす精密さと各段階で得られた知見を後続コホートに適用可能な柔軟性を兼ね備えたプロトコルの運用化にまで及びます。
- 弊社はアジア人集団を対象としたエスノブリッジング試験のデザイン・実施における先駆者としてこのアプローチを発展させ、早期フェーズ試験において他のサブ集団を費用対効果の高い方法で組み込む手法を確立しています。
Our solution experts
Oliver Fuhrmann, Ph.D.
Executive Vice President, Early Phase Development & Regional Head Europe for Clinical Research Innovations
Sanjay Vyas
Executive Vice President, India Country Head & Managing Director, Global SBU Head -Safety Services & Logistics
Karen McIntyre
Vice President, Global Site Alliances, Launch Excellence
Shaun Martin
VP, Integrated Solutions
Angela Qu, M.D., Ph.D.
Senior Vice President, Biomarker Genomic Medicine
Paul Bridges, Ph.D.
President, Consulting
Mwango Kashoki, M.D., MPH
Senior Vice President, Global Head of Regulatory Strategy
Our solution experts
Oliver Fuhrmann, Ph.D.
Executive Vice President, Early Phase Development & Regional Head Europe for Clinical Research Innovations
Sanjay Vyas
Executive Vice President, India Country Head & Managing Director, Global SBU Head -Safety Services & Logistics
Karen McIntyre
Vice President, Global Site Alliances, Launch Excellence
Shaun Martin
VP, Integrated Solutions
Angela Qu, M.D., Ph.D.
Senior Vice President, Biomarker Genomic Medicine
Paul Bridges, Ph.D.
President, Consulting
Services
フェーズ Ⅰ
フェーズ Ⅰでは初めてヒトで薬剤を試験します。酵素も生物学的性質も異なる2つの生物種間で同等性を示すことは技術的に困難ですが、弊社のトランスレーショナル サイエンス チームは、取得した動物データを正確にヒトデータに変換し、その結果、迅速かつ信頼性の高いヒト初臨床試験に移行することができます。
ヒト試験は法域を問わず厳しく規制されています。弊社の経験と主要な規制機関との関係は、いつどこでヒトでの臨床試験を開始し、必要な検証データを作成するかを決定するのに役立ちます。初期段階の提携クリニックのネットワークと、臨床薬理学およびモデリング シミュレーションの経験豊富なチームが、フェーズ Ⅰまでの迅速かつ確実な進行をサポートします。
PoC (概念実証):フェーズ Ⅰb-Ⅱa
弊社のトランスレーショナル サイエンス部門は、成功のために必要な基盤を提供し、健康なヒトから得られたデータを患者さんに移すことで、生化学的プロセスが同じであることを確認します。私たちは必要な投与量を決定することに重点を置き、その薬剤が疾患を治療していることを投資家に示すのに十分なデータを生み出すことに取り組んでいます。
この目標を達成するために、弊社はすべての主要治療分野にわたってサポートを行い、グローバルな治験担当医師ネットワークへのアクセスを可能にし、ワールドワイドで開発を加速するためのエスノブリッジング試験を提供します。
患者エンゲージメント戦略とエンロールメント ソリューション
臨床試験参加者の多くは試験に関する情報が不十分であったり、受診の時間や場所が不便であるため、参加することへの障壁に直面しています。その結果、一部の患者集団は可能性のある治療を利用することができず、研究は広範な有効性を確保するために必要な参加者の多様性を欠いています。
弊社は患者さんへのアクセスと、治験への参加という問題に焦点を当てています。広く募集を行い、研究全体を通じて適切かつ多様性のある集団を調査します。患者さんの嗜好を把握し、適切なコミュニケーションを維持することで、必要な参加者の多様性を確保し、維持するお手伝いをします。
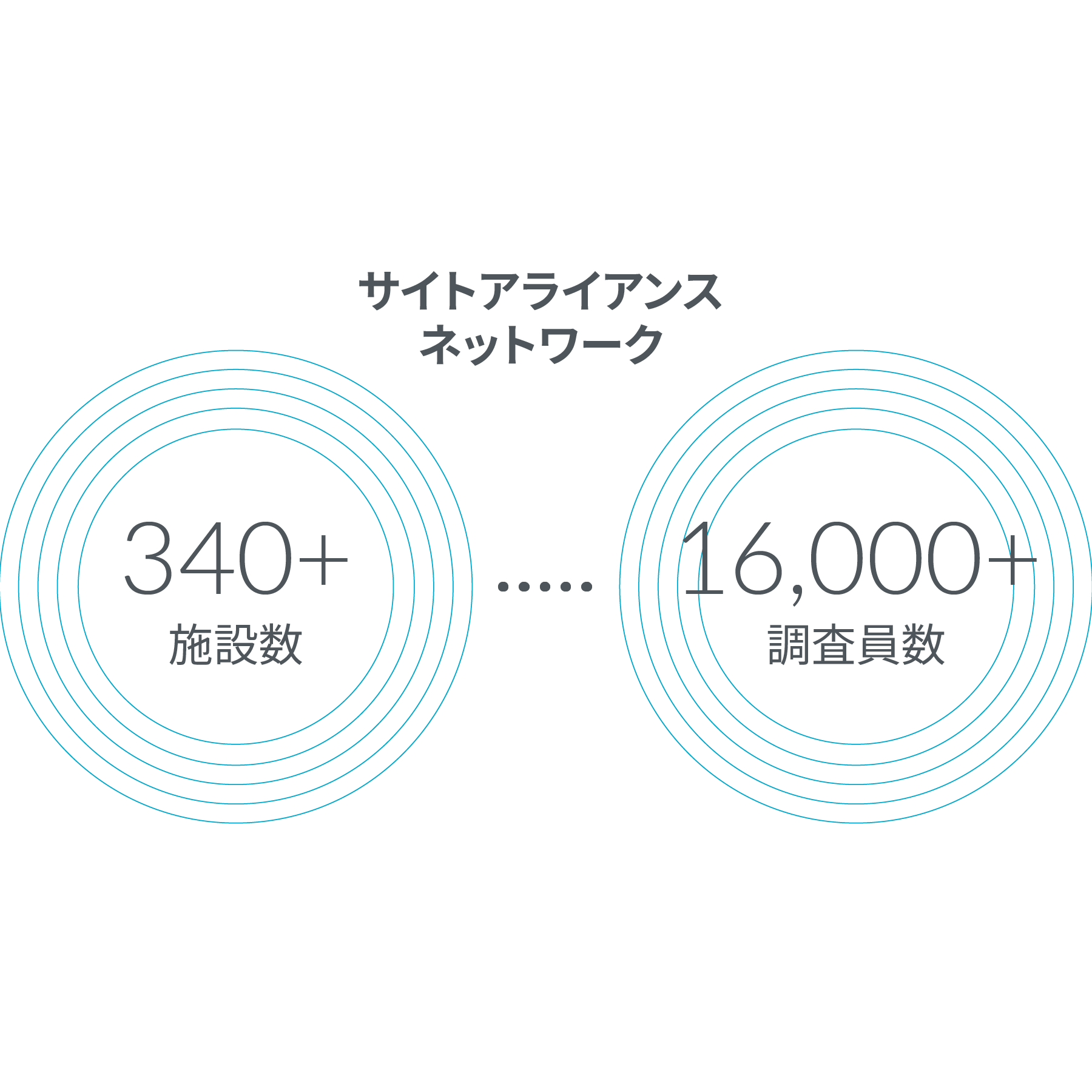
サイトアライアンス ネットワークとKOL (キーオピニオンリーダー)エンゲージメント
臨床試験では参加者の確保と維持が課題となっており、それによって試験の遅延、早期終了、信頼性の低い結果がもたらされます。潜在的な参加者となる患者さんとその担当医が、臨床試験の機会について知ることは困難です。また臨床試験の開始は複雑なため、さらに遅れが生じることもあります。これらの要素すべてが研究の進展の妨げとなります。
弊社は治験実施施設や治験責任医師のネットワーク、地域の医師や専門医とのコネクションを提供することで、患者さんが確立された医療提供システムを通じて治験に参加できるようにします。またIRB (治験審査委員会)とのパートナーシップにより、承認までの時間を短縮することが可能です。さらにオピニオンリーダーとの関係構築により、スポンサーはプロトコルの開発開始前に起こりうる障壁を特定することができます。
プロトコルの最適化
試験の立ち上げはますます困難になってきています。プロトコルはより複雑になり、必要な第三者データの量も増え、治験実施施設の管理も難しくなっています。弊社は適切な施設を選択し、プロトコルが募集する参加者集団に不必要な負担をかけないようにすることで、お客様と治験責任医師によりスムーズなプロセスを提供します。
パレクセルの臨床判断プログラムは、プロセスの初期段階で潜在的な問題を特定します。弊社の医薬品安全性とファーマコビジランスは、試験参加者のリスクとベネフィットを継続的にモニタリングし、起こりうる安全上の問題を即座に特定します。また医療経済モデリングは経済的なエンドポイントを試験に導入し、最終的に医薬品の費用対効果を明確にします。
レギュラトリー戦略
開発の初期段階における規制への計画とリスク軽減は、医薬品開発を成功に導く大きな要因です。プロダクト開発の初期段階において、レギュラトリーインテリジェンス、戦略的レギュラトリーアドバイス、規制当局への仲介とエンゲージメント、規制ギャップ分析、プロダクト開発計画などのために、元規制当局者や業界のスペシャリストで構成される弊社のグローバルチームと連携してください。

弊社のグローバル コンサルタント チームには、FDA (米国食品医薬品局)、EMA (欧州医薬品庁)、NMPA (中国国家薬品監督管理局)の元規制当局者も含まれているため、安心して治験を進めることができます。
マーケットアクセス戦略とデリバリー
保険者が必要とする完全なエビデンスパッケージを構築します。パレクセルでは適切なエビデンスを収集するために、レギュラトリー、アクセス、HEOR (医療経済・アウトカムリサーチ)、RWE (リアルワールドエビデンス)、患者報告アウトカム (PRO)を統合した完璧な体制を整えています。これらは早期に開始することが重要であり、その結果、研究のライフサイクルを通じてプロダクトのエビデンスに基づくバリューストーリーを開発し、適応させながら償還に関連するリアルワールドの視点から利益を得ることができます。
バイオマーカーとゲノム医療戦略
バイオアナリシスとゲノム研究は、医薬品開発と試験デザインに不可欠です。開発プロセスの早い段階でターゲットバイオマーカーや遺伝子変異を特定すれば、新薬を実現するために必要なステップが明確になります。試験の対象となる患者さんをより正確かつ自信を持って選択し、試験をデザインする際に適切な質問を行い、市場参入の際には医薬品の利点をより明確に説明することができるようになります。
パレクセルでは、お客様が勝機を見出すバイオマーカーおよびゲノム医療戦略を開発するための包括的なポートフォリオを提供しています。
治験薬の供給とロジスティクス
小規模な地域治験であっても、複雑な国際共同治験であっても、その国特有の知識と現地当局との密接なつながりのある強固なサプライチェーンネットワークが必要になります。弊社はエンドツーエンドの臨床試験サプライチェーンマネジメントを実現するための知識、システム、コネクションを提供します。国際的なプレッシャーを乗り越え、予定通りに患者さんや治験実施施設に医薬品を届けるサプライチェーンの構築をお手伝いします。
お客様が世界中で自由に治験を実施できるように、弊社は治験担当医師の施設に医薬品や補助用品 (ancillary supplies)をシームレスに移動させるハブアンドスポークのデポネットワークを運営しています。弊社の熟練した貿易コンプライアンスの専門家チームが税関申告、許可申請、現地政府とのやり取りを管理するため、お客様は患者さんにとって最良の治験の実施に専念することができます。

弊社は2021年度の最優秀臨床サプライチェーン賞、2020年度の最優秀デジタルサプライチェーン賞、2019年度の最も堅牢なCROサプライチェーン賞など、複数のアジア太平洋バイオプロセシング エクセレンス賞を受賞しています。
患者さんのインクルージョン
臨床試験は多くの場合、患者さんにとって包括的なものではなく、排他的な空間であり、その結果、少数派グループの患者さんに深刻な影響を及ぼしてきました。パレクセルはこの状況を変えることを使命としています。私たちは患者さん、介護者、医師、コミュニティリーダーと直接話し合い、患者さんが臨床試験に登録することを妨げる要因を特定しました。
試験デザインプロセスにおいて、公平性とインクルージョンに取り組むために、弊社はお客様にご協力する準備が整っています。パレクセルは時間や経済的な問題、交通手段などの問題のために参加できなかった患者さんを含めた試験をデザインするお手伝いをします。インクルージョンを重視することで、より多くの患者さんを支援し、すべての人に有効な医薬品や治療法を開発することが可能となります。

TriNetX Liveを通じて、30カ国以上から数百万人の多様な患者さんのネットワークにアクセスすることができます。
メディカルコミュニケーション
弊社は最も考慮すべき人々に試験へ参加していただきます。パレクセルでは、臨床開発、患者エンゲージメント、リアルワールドエビデンス、医療経済、マーケットアクセス、レギュラトリーなどに関する専門知識だけでなく、すべての主要な治療分野におけるメディカルコミュニケーションサービスの包括的なポートフォリオを組み合わせ、お客様のステークホルダーに重要なデータをお伝えします。
弊社のチームは、メディカルアフェアーズのストラテジストや熟練した博士、薬学博士、メディカルライター、医学編集者、ロジスティクスの専門家、デジタル デザイン クリエイティブのスペシャリストたちによって編成されています。私たちは開発のあらゆる段階において、教育的な経験を高め、お客様の科学に命を吹き込みます。
Operational excellence
治験の実施方法を常に進化させています
オペレーショナル エクセレンス デリバリー オフィスの目的は、治験の実施方法を継続的かつ一貫して改善することです。経験豊富なクロスファンクショナルなチームメンバーを集め、スケジュールを短縮します。そして説得力のあるエビデンスを作成し、イノベーションを促進することで、With Heart™を実現するためのベストプラクティスビジネスを創造します。