開発プロセスの極めて重要な局面において、規制当局の卓越したインサイトを引き出す
早期の規制当局への計画と関与は、開発を保護し、落とし穴を避け、プロダクトを成功に導くための基本です。元規制当局者を含む弊社のチームから、お客様の計画が規制当局からどのように評価されるかを洞察してください。そこからガイドラインを解釈し、お客様のアセット開発プログラムの可能性を最大限に引き出します。
開発プロセスにおけるこの極めて重要な時点で、レギュラトリーパスウェイを管理し、コンプライアンス上のリスクを軽減することで、患者さんへの治療薬提供までの道のりを簡素化し、加速させることができます。弊社のサポート分野は以下の通りです。
- 統合されたプロダクト開発計画:非臨床、CMC (化学・製造および品質管理)、臨床、医療、レギュラトリー、マーケットアクセス戦略など、医薬品開発の主要な要素を統合した計画です。これらの重要な分野を統合することで、遅延を最小限に抑えて効率を改善し、異なるチームやステークホルダー間の連携を強化します。
- 規制当局とのエンゲージメント:グローバルな規制当局との早期かつ頻繁な関わりは非常に貴重であり、弊社はこうしたやり取りを戦略的にサポートします。規制当局との最適な関わり方を策定することで、規制当局の期待や要件をナビゲートすることができます。弊社のインサイトとアプローチを活用することで、規制当局と自信を持って効果的にコミュニケーションを図ることができます。
- プロトコルの最適化:患者さん、規制当局、保険者を含むすべてのステークホルダーのデータのニーズを考慮します。試験プロトコルを微調整することでデータの質を高め、より効率的な意思決定を可能にし、円滑な開発プロセスを促進します。弊社の最適化されたプロトコルは、規制当局や保険者の期待に応えつつ、患者さんにとって有意義な結果をもたらします。
- 徹底した品質管理 (First-time quality)に基づいた規制当局への提出:品質管理を優先することで正確で完全な規制関連文書を作成し、承認取得の可能性を高めます。このアプローチは、規制当局との良好な関係と認識を維持するために極めて重要です。
- GxP査察の準備:グローバルな施設査察の経験が豊富なFDA (米国食品医薬品局)をはじめとする元規制当局者から構成された弊社のチームは、お客様の施設が必要なコンプライアンス要件をすべて満たすために何が必要かを理解しています。私たちの積極的なアプローチは、お客様の業務を中断させたり、プロダクト承認の遅延を引き起こす可能性のある指摘事項や、コンプライアンス違反のリスクを最小限に抑えます。
- アウトソーシング:効率性とリソースの有効性を高め、プロダクトへの投資対効果を最大化するために、弊社はアウトソーシングサービスを提供しています。弊社のチームは、グローバル登録、機能的サービス (CMCなど)、グローバルなメンテナンス業務を行うことで、お客様の社内リソースを解放します。このような戦略的なリソースを配分することで、イノベーションを推進し、長期的な目標に向かって前進することが可能となるのです。同時にお客様のアセットのグローバルな露出を確保し、すべての市場において現地の規制を遵守することができます。
高度な分析によるリスクベースの品質管理
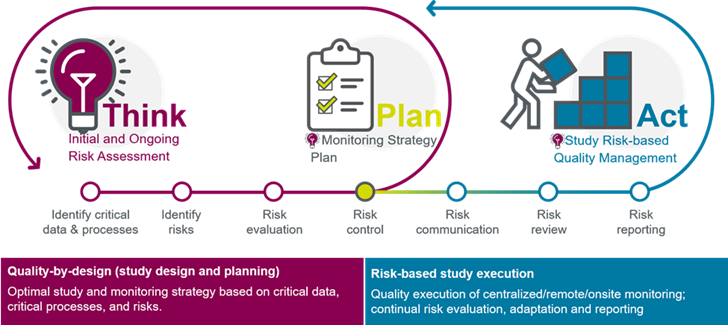
リスクベースの品質管理サービス (RBQM)により、潜在的なリスクが負債になる前に、データ品質の問題を初期段階で特定、把握、管理します。このアプローチは、試験のリスク評価、複雑性、国の要件、サイトのモニタリング、将来性を重要な考慮事項とし、目的に合ったモニタリング戦略の基礎を形成します。
信頼できるパートナー
臨床開発の初期フェーズから販売承認、そしてライフサイクル メンテナンスに至るまで、パレクセルの1,000名以上のレギュラトリー専門家 (80名以上の元規制当局者を含む)は、医療プロダクト開発を加速させ、合理化するための知識、システム、テクノロジーを駆使したプロセスを提供します。エンドツーエンドの専門知識と110カ国以上での経験を生かし、戦略的なレギュラトリーに関するアドバイスを提供し、リスクを予測して管理することで、頻繁に変化する薬事規制のハードルを乗り越えます。
最新のインサイト
業界の最新トピックについて専門家の意見をお聞きになりたいですか?弊社のインサイト センターをご覧ください。